继美国FDA批准首个间充质干细胞(MSC)药物上市后,我国紧随其后,迎来了新的重要里程碑!
2025年1月2日,国家药品监督管理局通过优先审评审批程序,附条件批准艾米迈托赛注射液(商品名:睿铂生)上市。这是我国首个干细胞药物正式获批,适应症为治疗14岁以上以消化道受累为主的激素治疗失败的急性移植物抗宿主病(GVHD)。

△ 国家药品监督管理局官网
这款药物的问世,无疑为整个干细胞行业注入了强心剂,标志着我国干细胞技术从实验室走向临床,从理论研究迈向实际应用。这也意味着间充质干细胞(MSC)药品的发展前景更加明朗,路径更加顺畅。此项突破不仅为GVHD患者提供了新的治疗选择,也为干细胞疗法的进一步发展和产业化奠定了坚实基础。
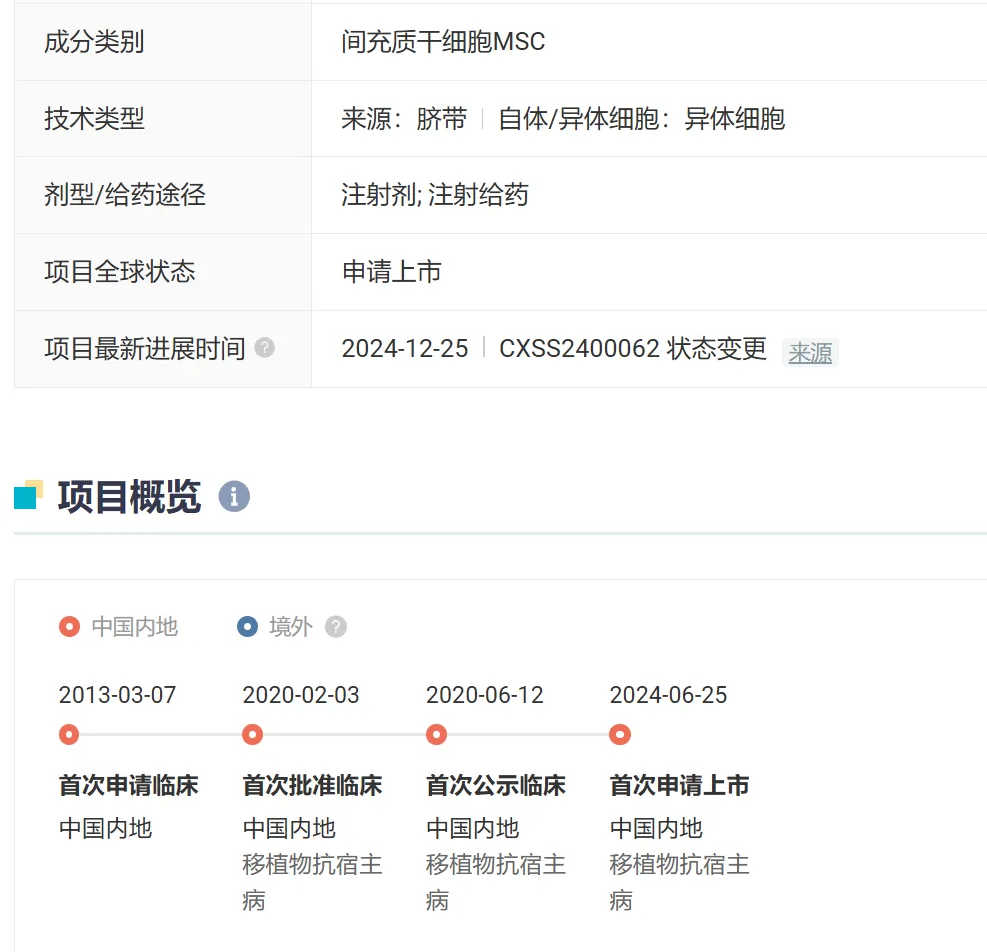
△ 我国首款干细胞药品概览
受到该利好消息刺激,1月3日A股干细胞概念板块逆势走高。截至中午收盘,中源协和(600645.SH)报21.09元/股,涨7.99%;冠昊生物(300238.SZ)报12.28元/股,涨3.72%。
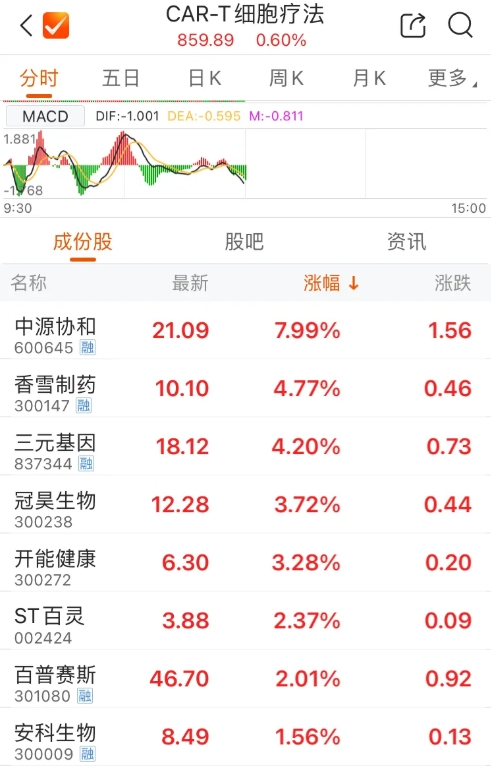
△ 1月3日A股干细胞概念板块逆势走高
据悉,移植物抗宿主病是异基因造血干细胞移植术后主要并发症之一,病情严重时可能引起死亡。该药品作为处方药上市,将在医院凭医生处方用于治疗相应疾病,为患者提供新的治疗选择。
该项干细胞新药目前已完成 II 期临床试验,III 期临床试验正在进行中。虽然在探索性 II 期临床中,MSC 组相较于安慰剂组在第28天时没有显示出更高的ORR。然而 MSCs 在平均2周后逐渐显示出治疗效果。完成8次输注的患者可能会从MSCs中获益,特别是那些肠道受累的患者。
国家药监局药品审评中心副主任王涛表示:从2017年开始,到现在我国干细胞一共批准了有120多款(药品)进入临床试验阶段,适应证包括血液系统、呼吸系统、心血管系统还有一些自身免疫系统疾病。
细胞治疗产品是全球医药发展的前沿和热点。国家药监局持续深化药品审评审批制度改革,设立加快临床急需新药上市通道,加强政策引导,完善评价体系标准,加强技术指导和沟通交流服务,助力创新疗法早日惠及患者。
近年来,国家出台了一系列支持政策,为干细胞药物的研发和产业化奠定了基础。例如,北京市药监局于2024年核发全国首张干细胞《药品生产许可证》,标志着干细胞药品的生产监管迈入规范化阶段。
2024年,国家药监局批准了48个创新药物上市,其中包括一批针对罕见病等重点领域的新药和好药,这些创新药物的加速上市满足了公众日益增长的用药需求。部分创新药物实现了全球同步研发、申报、审评和上市,甚至在全球首度上市,进一步彰显了我国在生物医药领域的创新能力。
与此同时,各地的商业保险和惠民保险政策逐步覆盖干细胞治疗项目,显著提升了患者的治疗可及性。随着监管体系的完善和技术的不断进步,未来将有更多创新药物进入市场,为患者提供更为丰富的治疗选择。
我国首款干细胞药品的获批上市,不仅是我国生物医药领域的重要里程碑,也是全球干细胞产业发展的关键标志。它向世界证明,干细胞疗法不仅仅是理论上的美好蓝图,更是现实中触手可及的希望。在未来的黄金十年里,我们期待干细胞技术能够为更多疑难杂症带来治疗新机遇,为人类健康提供创新的解决方案。