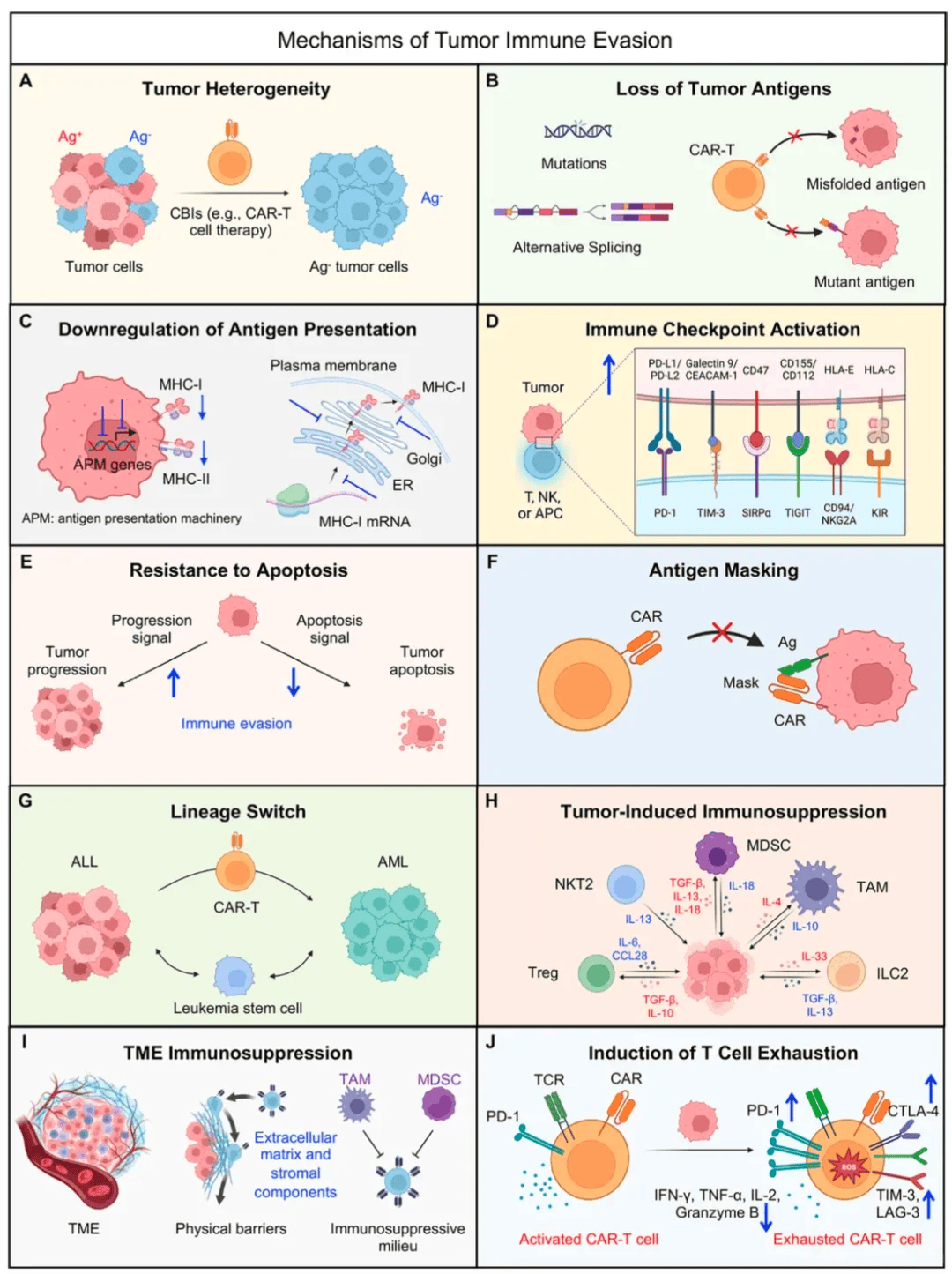
A. 肿瘤异质性
肿瘤内部存在抗原表达阳性(Ag⁺)和阴性(Ag⁻)的不同细胞群体。在免疫治疗(例如CAR-T疗法)有效清除Ag⁺肿瘤细胞后,Ag⁻细胞仍可继续增殖,造成治疗抵抗。这一现象反映了肿瘤在抗原表达上的异质性如何促进其逃逸免疫清除。
B. 肿瘤抗原缺失
肿瘤细胞可通过基因突变或RNA选择性剪接等机制,引起肿瘤抗原的错误折叠或结构变异,导致CAR-T等免疫效应细胞难以识别相应抗原,从而实现免疫逃逸。
C. 抗原呈递功能减弱
肿瘤细胞可抑制抗原呈递机制相关基因的表达,或在MHC-I类分子(有时也包括MHC-II类)的合成、转运(如从内质网到高尔基体再到细胞膜)过程中发生障碍,造成MHC分子表达下降,阻碍T细胞对肿瘤抗原的识别。
D. 免疫检查点通路激活
肿瘤细胞表面高表达如PD-L1/PD-L2、Galectin 9、CD47、CD155等免疫调节分子,通过与免疫细胞(包括T细胞、NK细胞及抗原呈递细胞)上相应受体(如PD-1、TIM-3、SIRPα、TIGIT等)结合,传递抑制性信号,削弱免疫细胞的杀伤能力。
E. 抵抗细胞凋亡
肿瘤细胞通过增强自身增殖信号、同时减弱凋亡信号,能够抵抗由免疫细胞所诱导的凋亡过程,进而在免疫压力下继续存活和增殖。
F. 抗原遮蔽
肿瘤细胞表面可能存在某些遮蔽结构,阻止CAR-T细胞识别并结合肿瘤抗原,从而削弱其对肿瘤细胞的靶向杀伤能力。
G. 谱系转换
某些肿瘤(如白血病)可通过谱系转换实现免疫逃逸,例如从急性淋巴细胞白血病转变为急性髓系白血病,从而逃避针对原谱系抗原的CAR-T治疗。白血病干细胞也可能参与该逃逸过程。
H. 肿瘤驱动的免疫抑制
肿瘤细胞通过分泌TGF-β、IL-10、IL-13等细胞因子,募集并激活具有免疫抑制功能的细胞,例如调节性T细胞、髓系来源抑制细胞、肿瘤相关巨噬细胞、NKT2细胞及ILC2细胞等,进而形成局部免疫抑制状态。
I. 肿瘤微环境中的免疫抑制
肿瘤微环境中的细胞外基质和基质细胞可形成物理屏障,阻碍免疫细胞浸润;同时肿瘤相关巨噬细胞、髓系来源抑制细胞等免疫抑制细胞在局部聚集,共同塑造出一个有利于肿瘤逃避免疫攻击的微环境。
J. 诱导T细胞耗竭
在持续抗原刺激下,CAR-T等免疫细胞表面会高表达PD-1、CTLA-4、TIM-3、LAG-3等抑制性受体,同时分泌效应分子(如IFN-γ、TNF-α、IL-2、颗粒酶B等)的能力下降,最终进入功能耗竭状态,丧失清除肿瘤的能力。
综上所述,上述机制共同构成了肿瘤逃避免疫监视与清除的复杂网络,也是当前免疫检查点抑制剂、CAR-T等免疫治疗方法出现耐药的重要原因。深入理解这些逃逸机制,对开发新的抗肿瘤策略具有关键意义。