从百万神针CAR-T免疫细胞疗法屡创癌症治愈奇迹,到《Nature》预言:干细胞疗法将在5-10年内治疗心血管疾病、帕金森、糖尿病等疾病。细胞疗法似乎正在兑现科学家的预言,逐渐拉开第三次医疗革命的序幕。
对此,有人开始未雨绸缪,他们将当下健康有活力的干细胞或免疫细胞储存起来,以待将来有需要时使用,还有人认为使用同种异体来源细胞也并无不可,但这两种选择都会遭遇一个共同的关卡——细胞冻存。
那么,当前的冻存技术真的能让细胞“保鲜”吗?待5年、10年或20年后要使用时,这些细胞是否还风采依旧,保持着原来的活力和效用?
事实上,50年前的细胞就已经能够给我们答案。
01
跨越几十年
细胞还能“保鲜”吗?
1776年,意大利生物学家Lazaro Spallanzani以雪为介质,将玻璃瓶中的马精子冷冻了10分钟,待自然解冻后出现了神奇的一幕,原本冻住的精子竟再次“焕发生机”,Spallanzani当即将冷冻时间延长到数十分钟,现象仍然存在,于是他得出结论:冷不能“杀死”精子。
这是后世低温保存的伏笔,但真正的技术“觉醒”却发生在20世纪50年代,在低温实验中屡战屡败的研究者终于意识到:“简单粗暴”的降温会让细胞内部的水分凝结出锋利的冰晶,“刺伤”细胞产生内源性机械损伤。为杜绝这种伤害,英国生物学家Christopher Polge开始在冻存过程中加入了保护剂——甘油。至此,冻存技术迈入正轨。

△迅速降温会导致细胞内产生冰晶,刺破细胞膜及细胞器
据不完全统计,繁殖培育中最古老的精子储存于1968年。2018年,这些精子跨越半个世纪成功让34只母羊怀孕,而按照它们活性依旧的状态,似乎再过几十年也能继续创造奇迹。

△左图为1959年出生的父亲——弗雷迪爵士,右图是2018年出生的孩子
生殖细胞能冻存超50年,那细胞疗法中的干细胞和免疫细胞也一样吗?
2012年,以“冷冻生物学”为主方向的期刊《Cryobiology》曾有文章描述过冻存23-25年的骨髓间充质干细胞(BMSCs)的状态,其中提到:经过适当的解冻和培养,低温保存长达25年的骨髓干细胞仍然能作为实验中间充质干细胞的来源,其生物学特性如细胞形态、分子标记、细胞生长、增殖能力和分化潜力均符合预期。
近期来说,来自哥伦比亚的研究者们对比了冷冻间充质干细胞药物(CellistemOA)与曲安奈德在骨关节炎治疗上的效用差异,30名Kellgren-Lawrence II或III级的膝骨关节炎患者参与了这场“较量”。
结果指向“现货型”的间充质干细胞更胜一筹——显著镇痛、提高膝关节功能,并在随访一年后仍稳定提高患者的生活质量。值得一提的是,相较于副作用繁多的常用药,干细胞也更加“温和”,组内患者均未出现严重的不良反应,是兼具疗效与安全性的潜力药物。这些结果将推动CellistemOA迈向下一个实验阶段,也为干细胞冷冻成药提供了新的证据。

△单剂量冻存人脐带间充质基质细胞治疗膝骨关节炎的疗效:一项随机、对照、双盲初步研究
免疫细胞方面,2018年,麦克马斯特大学病理学和分子医学系从新鲜、短期冻存(<1年)及长期冻存(1-10年)的脐带血中提取NK细胞,比较后发现冻存时间的长短并不会影响NK细胞的扩增潜能和抗肿瘤能力,比如在对抗乳腺癌细胞时,就与新鲜NK细胞不分伯仲。
而在CAR-T免疫细胞疗法兴起的背景下,也有研究者着手探索了冷冻外周血单核细胞(PBMC,获取免疫细胞的重要原料)生成CAR-T细胞的能力。
在这里,经历了冷冻、解冻和培养的PBMC依旧“能打”——产生了足量、合格的CAR-T细胞,产物的体外抗肿瘤反应性也与新鲜PBMC产出的相似。而处于制备流程中的CAR-T细胞同样被研究者冷冻了8-61天,在解冻后这些细胞一路增殖,展现出高抗肿瘤效力和特异性。
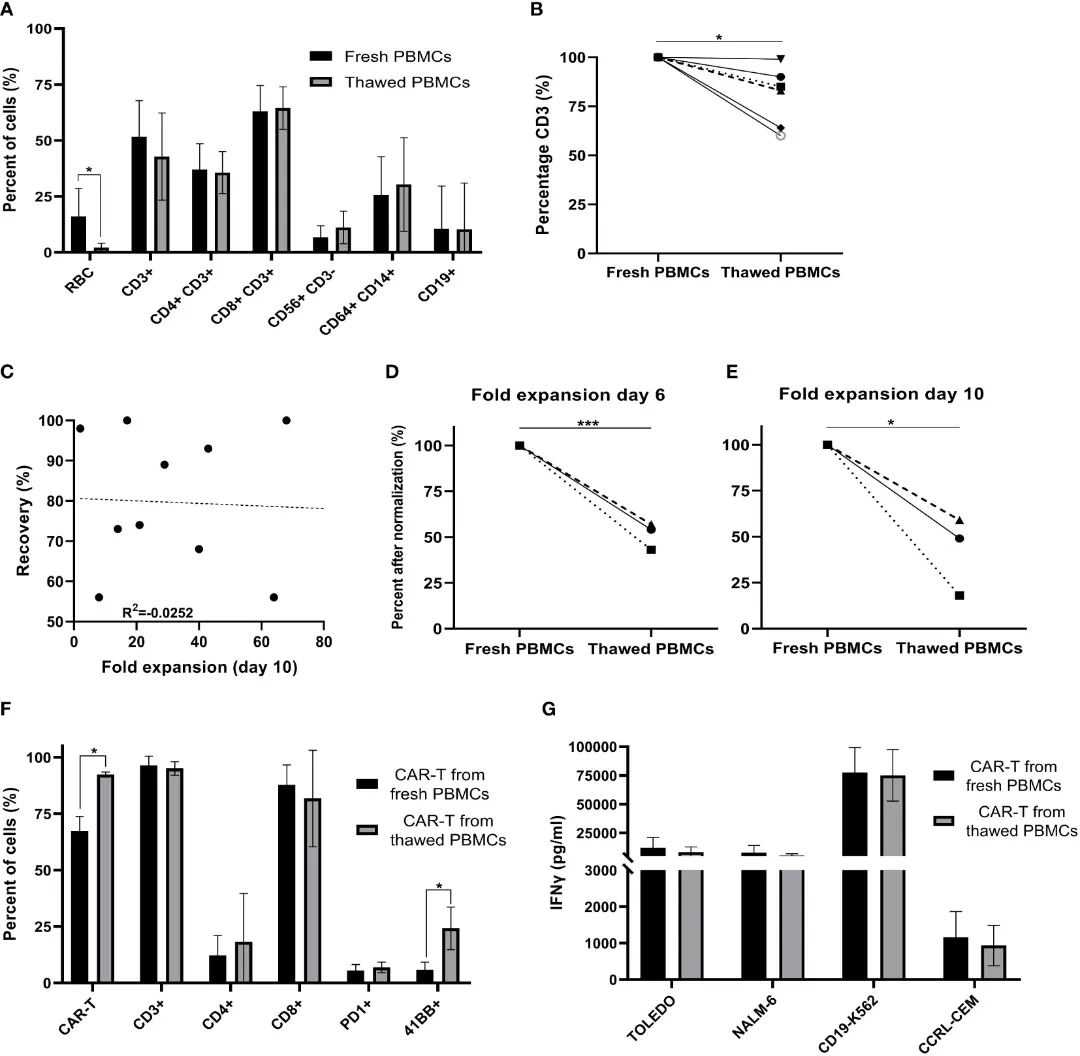
△新鲜PBMC和冷冻保存/解冻的PBMC对比
综合这些研究,我们可以得出:细胞冻存确实能够在低温状态下长期“保鲜”,并在“复活”后风采依旧,但这是凭何做到的呢?
02
深低温冻存
为细胞按下“暂停键”
首先,我们要说到细胞通常的存储环境——-196℃。这种深低温常由液氮塑造,原因有三:
1、-196℃可冻结生命活动,当周边环境降至-120℃时,细胞内部便不再发生热依赖性代谢过程,而当数值来到-196℃,此时细胞内能极小,分子运动趋近于停止,细胞内的时间就像被按下了“暂停键”。因此理论上,在液氮环境里的细胞是可以实现“永生”的。

△在-196℃的环境里,细胞是可以实现“永生”的
2、液氮具备优秀冷却剂的特质。它无色无味,性质非常不活泼,基本不会对被冻存物体的化学性质产生影响。
3、液氮的制成更方便安全。尽管液氦(-268℃)温度更低,但氮气作为大气中含量(78%)最高的气体,制成液氮后可更广泛地用于实验与冻存中,这是作为稀有气体的氦气无法比拟的优点。更何况,-196℃的低温对于大多数实验来说已经绰绰有余。
其次,如前文提到的,直接降温会伤害到细胞的结构,损坏其中蛋白质,因此,为了让细胞能够安然无恙地跨过200度的温差,研究者基本会遵循“慢冻速融”的原则。
其中“慢冻”实行的是梯度降温法,通过逐级降温,让细胞有足够的时间适应温差,如一些实验室会按照4℃,-20℃,-80℃,-196℃(液氮)的顺序给细胞降温,并稍作停留(部分实验会让细胞在-80℃维持1-2天再继续降温),以减少冻存过程对细胞造成的损伤。
在这个过程中,研究者还会加入第二重保险:冷冻保护剂,比如当前颇受青睐的冷冻保护剂——二甲基亚砜(DMSO)与胎牛血清(FBS),前者是一种含硫有机物,不但能平衡细胞内外的电解质浓度,还能通过与水分子形成高能氢键,降低冰点,减少细胞内部冰晶的形成。后者在为细胞提供营养的同时,还能保护细胞不受损伤。
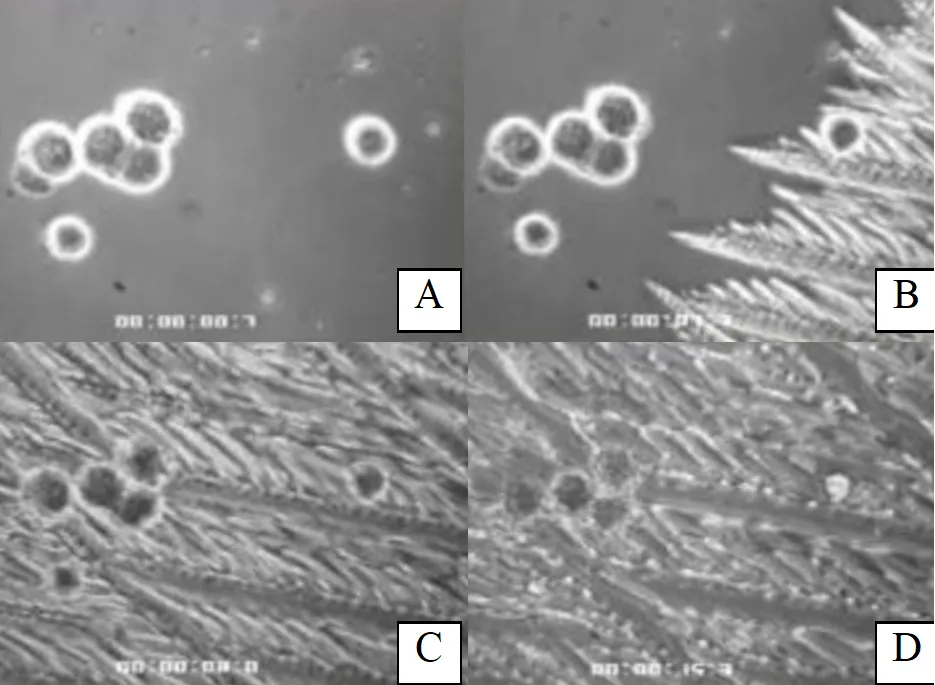
△低温电镜下细胞降温过程,若没有冷冻保护剂保护,细胞内容易形成胞内冰(黑色细胞)
而“速融”,顾名思义,可理解为快速解冻,操作员会将待解冻的细胞置于37℃的温水中,轻轻摇晃,随后将混在细胞溶液当中的冷冻保护剂去除。
可以说,“慢冻速融”是当下冻存的“标配”,不过,由于缺乏统一标准,目前实验室基本都是根据自身经验来选择与操作,《Journal of Translational Medicine》上曾有篇综述统计了2019年前与“冻存对骨髓间充质干细胞的功能影响”有关的研究,在41项符合标准的实验里,竟然没有一个冻存方案是完全重合的。

△冷冻保存对骨髓间充质干细胞的影响:系统评价
迥异的方案下,解冻后的间充质干细胞的形态、表面标志物表达、分化或增殖潜力没有差异。然而,其他数据就没有那么坚守了,尤其是存活率,其中有解冻后存活率稳住100%的满分答卷,也有存活率直接腰斩的尴尬数据。
只要能给予合适的冻存方案,处于-196℃深低温条件下的细胞可以在冻存5年、20年、甚至上百年之后依旧保持高质量,而待未来细胞科技成熟,这份细胞将能真正“跨越时空”,为人们留下生的希望。