系统性红斑狼疮 (SLE) 和狼疮性肾炎 (LN) 是使人衰弱的自身免疫性疾病,其特征是病理性自身抗体产生和免疫功能障碍,引起慢性炎症和多器官损伤。尽管目前使用抗疟药、糖皮质激素、免疫抑制剂和单克隆抗体进行治疗,但最终治愈仍然难以捉摸,这凸显了对新型治疗策略的迫切需求。

△ CAR T 细胞疗法治疗系统性红斑狼疮:现状和未来展望
发表在知名期刊Frontiers的一篇研究“CAR T-cell therapy for systemic lupus erythematosus: current status and future perspectives”对 SLE 的 CAR-T 疗法的进展进行深入分析,重点关注其彻底改变这种复杂疾病治疗的潜力。
系统性红斑狼疮是一种严重的自身免疫性疾病,主要影响育龄妇女,在普通人群中的患病率为 0.1% 。SLE 的病因是多因素的,包括遗传易感性、环境触发因素和激素因素;然而,确切的机制仍不清楚 。其特征是自身抗体和免疫复合物沉积物的形成,导致多个器官的破坏或功能障碍,并不同程度地影响患者的寿命 。
SLE 表现出多种临床症状,包括疲劳、关节痛、皮疹、光敏性和肾脏炎症 。尽管过去十年治疗取得了进展,包括非甾体抗炎药、糖皮质激素、抗疟药和免疫抑制剂,但由于疗效有限和不良副作用,SLE 的管理仍然是一个重大挑战 。
鉴于 B 细胞在 SLE 发病机制中的核心作用,调节 B 细胞功能已成为减轻 SLE 自身免疫反应的关键治疗策略 。B 细胞靶向免疫疗法的最新进展,例如针对 CD20 和 B 细胞活化因子的单克隆抗体,在治疗严重和难治性 SLE 方面显示出前景 。
随着创新免疫疗法的进步,CAR T 细胞疗法在治疗难治性 SLE 患者方面具有巨大潜力 。大量临床前和临床研究表明,抗 CD19 和抗 BCMA CAR-T 细胞通过靶向 CD19+ B 细胞或 BCMA+ 浆细胞或双阳性浆母细胞,在治疗一系列自身免疫性疾病(包括 SLE)方面具有疗效。近年来,研究 CAR-T 疗法治疗 SLE 的全球临床试验的注册量显著增加,clinicaltrials.gov 项注册试验超过 30 项 。
01
CAR-T 细胞疗法的发展
CAR-T 细胞疗法是一种创新的肿瘤免疫疗法,涉及对 T 细胞进行基因修饰以表达识别肿瘤特异性抗原的受体。这种方法已成为各种恶性肿瘤的一种有前途的治疗策略。CAR-T 结构的开发始于 1990 年代,最初针对 B 细胞淋巴瘤。随后,CAR 的设计经历了不断的演变和完善。

△嵌合抗原受体 T 细胞的进化。(A) 第一代 CAR-T 细胞配备一个细胞外抗原识别结构域和一个细胞内 CD3ζ 结构域,负责信号转导。(B) 第二代 CAR-T 细胞配备一个细胞外抗原识别结构域和两个胞内结构域:CD3ζ 和一个额外的共刺激结构域。(C) 第三代 CAR-T 细胞包含一个细胞外抗原识别结构域和三个胞内结构域:CD3ζ 和两个额外的共刺激结构域。(D) 第四代 CAR-T 细胞,也称为“TRUCK”CAR,表现出与第二代 CAR 相似的结构,并具有可诱导的细胞因子表达谱,例如 IL-12,由活化 T 细胞的核因子 (NFAT) 反应启动子驱动。(E) 第五代 CAR-T 细胞整合了前几代的特征并引入了新元素,例如 IL-2R β 链,它能够激活 JAK/STAT3/STAT5 通路,以抗原依赖性方式进一步优化 T 细胞反应。CAR-T 细胞代的进化旨在提高癌症免疫疗法的疗效。
02
SLE 的免疫学特征和病理生理学
SLE 的免疫学特征主要涉及免疫系统激活失调,导致自身组织和器官损伤。以下是与 SLE 相关的一些关键免疫学特征:
(i) 自身抗体的产生增加,包括抗核抗体 (ANA)、抗双链 DNA 抗体 (anti-dsDNA)、抗磷脂抗体和其他特定的自身抗体。这些可以靶向身体组织,引起炎症和损伤;
(ii) 形成免疫复合物,由抗体及其抗原组成。这些复合物可以沉积在组织中,引发炎症反应并导致多个器官受损;
(iii) 炎症介质释放的增加,如 I 型干扰素 (I 型 IFN)、肿瘤坏死因子-α (TNF-α) 和白细胞介素-6 (IL-6),有助于与 SLE 相关的炎症过程和组织损伤;(iv) 患者血清中的循环免疫复合物 (IC) 触发补体系统,导致大量补体 C3 和 C4 耗尽。因此,这导致水平降低,这通常与 SLE 的活性有关 ;
(v) 免疫调节受损是 SLE 的一个标志,源于未能保持自我耐受的机制。调节性 T 细胞 (Tregs) 和其他免疫调节成分的功能受损加剧了 SLE 的自身免疫反应特征。
(vi) 有缺陷的胞吐作用对于从体内清除凋亡颗粒至关重要。

△ 系统性红斑狼疮 (SLE) 的病理生理学。(A) 中性粒细胞通过充当关键的炎症介质,通过 NETosis 释放瓜氨酸肽和核酸抗原,并驱动 I 型 IFN 表达,从而启动 SLE 中的致病性级联反应。(B) 凋亡细胞通过为 I 型 IFN 表达提供配体并释放 HMGB1 和核酸,促进抗核酸抗体产生和炎性细胞因子表达,从而促进 SLE 发病机制。(C) 巨噬细胞通过分泌促炎细胞因子(包括 TNF-α、IL-6 和 IL-8)引起组织损伤。(D) 抗原呈递细胞 (APC),包括 DC,内化自身肽和核蛋白,成熟并激活初始 T 细胞。这导致 T 细胞分化为 Th 细胞和细胞毒性 T 淋巴细胞 (CTL),激活 B 细胞产生自身抗体并诱导对核酸抗原的特异性自身免疫反应。这些自身抗体形成免疫复合物,导致终末器官损伤,这是 SLE 的特征。
03
CAR-T 细胞疗法治疗 SLE 的临床研究

△ SLE 患者 CAR-T 细胞治疗的程序和结果。(A) SLE 的 CAR-T 细胞治疗程序包括从患者身上分离和纯化 T 细胞。然后通过慢病毒转染制备这些 T 细胞用于 CAR-T 细胞治疗,然后进行体外增殖。随后,将 CAR-T 细胞静脉内输注到预先用环磷酰胺和氟达拉滨预处理的患者体内。(B) CAR-T 细胞治疗后患者的免疫学和临床特征从上到下描述:CAR-T 细胞和初始 B 细胞计数、蛋白尿、抗 dsDNA 抗体水平、C3 补体蛋白水平、C4 补体蛋白水平和 SLEDAI 评分随时间的变化。CAR,嵌合抗原受体;dsDNA,双链 DNA;SLEDAI,系统性红斑狼疮疾病活动指数。
CAR-T 细胞提供了一种有效的机制来消耗这些细胞并诱导无药物和持续缓解,特别是在常规治疗失败的难治性病例中。CAR-T 细胞疗法,尤其是靶向 CD19 的细胞疗法,在治疗难治性 SLE 方面显示出前景。预处理化疗对于淋巴细胞清除至关重要,可实现 CAR-T 细胞的最佳扩增和功能。
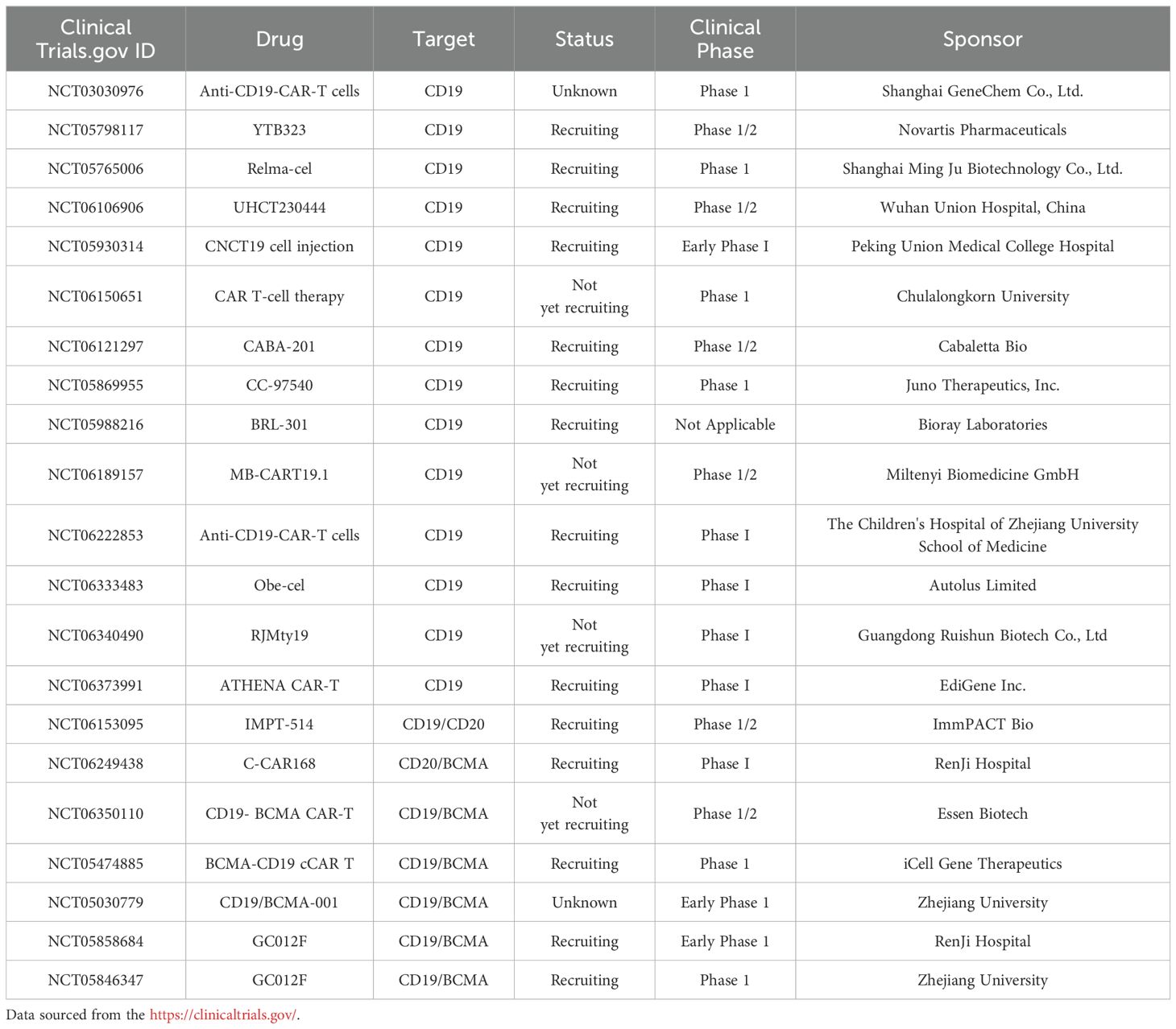
△ 使用 CAR T 细胞类型治疗 SLE 的临床试验总结
在安全性方面,cCAR-T 疗法显示出良好的耐受性,没有 CRS 或 ICAN 病例,也没有观察到明显的感染并发症,满足了与双特异性 BCMA/CD19 化合物相关的感染安全性结果的特定要求。

△ CAR-T 疗法在临床应用中的前景。(A) 联合疗法:利用免疫抑制剂、生物制剂或 BiTE 的协同组合来提高疗效并改善患者预后,同时最大限度地减少毒性。(B) 双特异性靶向:使两种不同的嵌合抗原受体 (CAR) 在单个 T 细胞内或跨不同 T 细胞表达,使 CAR-T 细胞能够识别多种抗原并靶向各种细胞群。(C) CAR-Treg 细胞疗法:引入靶向自身反应性免疫细胞的 CAR-Treg 细胞,利用抑制性细胞因子和免疫检查点通路(CTLA4、LAG-3)来抑制激活并诱导免疫耐受。(D) CAAR-T 细胞疗法:强调嵌合自身抗体受体 T 细胞 (CAAR-T 细胞) 通过 B 细胞受体 (BCR) 靶向自身反应性 B 细胞的潜力,为 SLE 提供了一种有前途的治疗策略。(E) SLE 的优化 CAR 设计:CAR-T 细胞分子组成的示意图,包括 CD3ζ 等信号结构域,具有不同的基于免疫受体酪氨酸的激活基序 (ITAM),可调节 T 细胞活化和细胞因子释放,对管理治疗相关毒性至关重要。CTLA4,细胞毒性 T 淋巴细胞抗原 4;LAG-3,淋巴细胞活化基因 3;IL-2,白细胞介素-2;IFN-γ,干扰素-γ;ITAM,基于免疫受体酪氨酸的激活基序。
写在最后
SLE 是一种复杂的自身免疫性疾病。越来越多研究表明异常 B 细胞活化在 SLE 中起关键作用 。CAR-T 细胞疗法代表了治疗 SLE 的新时代,临床试验证明其长期的体内持久性,为实现持续缓解和治愈疾病提供了新的视野。对临床前和临床研究的持续追求对于改进和验证 CAR-T 细胞疗法至关重要,这将使我们更接近 SLE 或其他相关自身免疫性疾病治疗的新时代。